宫颈癌规范化诊治指南
发布人:系统管理员 发布日期:2019-04-14 点击:次
宫颈癌规范化诊治指南
(试行)
中华人民共和国卫生和计划生育委员会 2011年
1 适用范围
本文规范了子宫颈癌的诊断、鉴别诊断和治疗原则及治疗方案。适用于全国市、县级医院及其医务人员对子宫颈癌及癌前病变的诊断和治疗。
2 缩略语
2.1 CA125:(carcinomar antigen)癌抗原125
2.2 CEA:(carcinoembryonic antigen)癌胚抗原
2.3 CIN:(cervical intraepithelial neoplasia)宫颈上皮内瘤变
2.4 CTV:(clinical target volume)临床靶区
2.5 FIGO:(International Federation of Gynecology and Obstetrics)国际妇产科联盟
2.6 LEEP:(Loop Electro-surgical Excisional Procedure)宫颈环形电切术
2.7 PTV:(planning target volume)计划靶区
2.8 SCC:(squamous cell carcinoma antigen)鳞状细胞癌抗原
3 诊治流程:
![]()
![]()
![]()
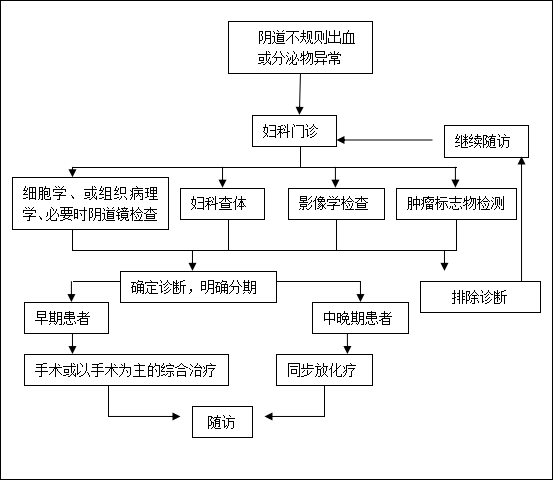
图1 子宫颈癌诊断与治疗流程
4 诊断依据
4.1 高危因素
1)首要病因:人乳头瘤病毒(HPV)感染是子宫颈癌及癌前病变的首要因素。
2)相关高危因素:过早性生活、多个性伙伴、多产、性伴侣的性行为混乱,吸烟、社会经济地位低下、营养不良等。
4.2 症状
接触性阴道出血,不规则阴道出血或绝经后阴道出血白带增多。
4.3 体征(妇科检查:临床分期是最重要手段,临床分期需要2名有经验的妇科医生决定,分期一旦确定不能改变)
4.3.1视诊 应在充足照明条件下进行,直接观察外阴和通过阴道窥器观察阴道及宫颈。除一般观察外应注意癌浸润范围,宫颈肿瘤的位置、范围、形状、体积及与周围组织的关系。
4.3.2触诊 肿瘤的质地、浸润范围及其与周围的关系等,必须通过触诊来确定。有些粘膜下及颈管内浸润,触诊比视诊更准确。三合诊检查可了解阴道旁、宫颈旁及子宫旁有无浸润,肿瘤与盆壁关系,子宫骶骨韧带、子宫直肠窝、直肠本身及周围情况等。
4.4 辅助检查
4.4.1宫颈/阴道细胞学涂片检查 它是目前发现子宫颈癌前病变(宫颈上皮内瘤变,CIN)和早期子宫颈癌主要手段,特别是对临床体征不明显的早期病变的诊断(宫颈/阴道细胞学诊断Bethesda报告)。
宫颈/阴道细胞学诊断Bethesda报告系统
报告格式:
a.说明标本量对诊断评价的意义
b.诊断总的范围
c.描述性诊断
标本量对诊断评价的意义:
评价满意
评价满意但是受限于---(具体原因)
评价不满意(具体原因)
诊断总的范围(最适的):
正常范围内
良性细胞学改变:见描述性诊断
上皮细胞异常:见描述性诊断
描述性诊断:
良性细胞学改变
感染
-滴虫阴道炎
-真菌形态符合念球菌属
-以球形菌为主的阴道菌群失调
-微生物形态符合放线菌属
-细胞学改变符合单纯疱疹病毒感染
-其它
反应性改变:
与下列因素有关的反应性细胞学改变:
-炎症(包括典型修复细胞)
-炎症性萎缩(萎缩性阴道炎)
-放疗
-宫内节育器(IUD)的影响
-其它
上皮细胞异常:
鳞状上皮细胞:
·未明确诊断意义的不典型鳞状细胞*
·鳞状上皮内低度病变包括:
- HPV+ *
-轻度非典型增生/CIN1
·鳞状上皮内高度病变包括:
-中、重度非典型增生
-原位癌CIS/CIN2和CIN3
·鳞状细胞癌
腺上皮细胞:
·绝经后妇女子宫内膜细胞,细胞学良性
·未明确诊断意义的不典型腺细胞*
·子宫颈管腺癌
·子宫内膜腺癌
·子宫外腺癌
·腺癌,非特异性
·激素水平评估(只用于阴道涂片)
·与年龄和病史相符的激素水平模式
·与年龄和病史不相符的激素水平模式;特异性(NOS)
·不能评价的激素水平;特异性
CIN:宫颈上皮内病变;CIS:原位癌
*不明意义的非典型鳞状/腺细胞应进行进一步追查,以证实是反应性还是癌前病变或癌。
+ HPV感染的细胞学改变包括在低度鳞状上皮病变内。
4.4.2组织学检查
CIN和子宫颈癌的诊断均应有活体组织学检查证实。如病变部位肉眼观察不明显,可用碘试验、涂抹3%或5%醋酸后或在阴道镜下提示活检部位。对于多次咬取活检仍不能确诊,需进一步采取较深部组织时可用切取法。当宫颈表面活检阴性、阴道细胞学涂片检查阳性或临床不能排除宫颈管癌时,或发现癌但不能确定有无浸润和浸润深度而临床上需要确诊者,可行宫颈锥形切除送病理检活检。
4.4.3腔镜检查
(a)阴道镜:对子宫颈癌前病变、早期子宫颈癌的发现、确定病变部位有重要作用,可提高活检的阳性率。在不具备阴道镜的医疗单位,也可以应用宫颈的肉眼观察,即宫颈涂抹3%或5%醋酸后或碘溶液后的肉眼观察,在有醋白上皮或碘不着色处取活检,送病理检查。
(b)膀胱镜、直肠镜:临床可疑膀胱或直肠受侵者应行相应腔镜检查。没有条件的单位转上级医院诊治。
4.4.4影像学检查
由于解剖部位表浅,绝大多数子宫颈癌,经妇科检查及细胞病理学检查即可确诊,影像学检查在子宫颈癌诊断中的价值主要是对肿瘤转移、侵犯范围和程度的了解(包括评价肿瘤局部侵犯的范围,淋巴结转移及远处器官转移等),以指导临床决策并观察疗效。
用于子宫颈癌的影像检查方法包括:
(a)腹盆腔超声:包括经腹部及经阴道(或直肠)超声两种方法。主要用于宫颈局部病变的观察,同时可以观察盆腔及腹膜后区淋巴结转移情况,以及腹盆腔其它脏器的转移情况。设备的优劣及操作者的经验影响诊断的正确率。
(b)腹盆腔CT:平扫CT观察宫颈局部病变效果不好,尤其是较早分期的病变;增强CT扫描利于宫颈局部病变的显示,但仍有近50%的病变呈等密度,不能清晰显示。CT检查可以客观评价宫颈病变与周围结构(膀胱、直肠等)的关系,以及淋巴结是否有转移,同时观察腹盆腔其它器官是否有转移。
(c)盆腔MRI:软组织分辨率高,是显示宫颈病变最佳的影像学方法,可以明确地分辨病变与周围的结构,明确病变与直肠、膀胱、阴道等的关系,依照MRI表现进行术前分期的准确率较高。同时也可以观察双侧腹股沟、盆腔及腹膜后区淋巴结转移情况。
(d)胸片及胸部CT:主要目的是为了排除肺转移,胸片应包括正、侧位,必要时进行胸部CT检查。
(e)骨扫描:仅用于怀疑有骨转移的患者。
4.4.5肿瘤标志物检查
肿瘤标志物异常升高,主要协助诊断,且对治疗的疗效评价、病情监测和随访具有重要作用。而在于治疗后的随访监测。
SCC:宫颈鳞状细胞癌的重要标志物,血清学水平超过1.5ng/ml被视为异常。因宫颈癌以鳞状细胞癌最为常见,所以SCC是子宫颈癌中最常检测的血清学标志物。
5 子宫颈癌及癌前病变的分类和分期
5.1 子宫颈癌的组织学分类
WHO子宫颈癌组织学分类(2003)
| 上皮性肿瘤 鳞状上皮肿瘤及其癌前病变 鳞状细胞癌,非特殊类型 8070/3 角化型 8071/3 非角化型 8072/3 基底细胞样 8083/3 疣状 8051/3 湿疣状 8051/3 乳头状 8052/3 淋巴上皮瘤样 8082/3 鳞状上皮移行细胞癌 8120/3 早期浸润性(微小浸润性)鳞状细胞癌 8076/3 鳞状上皮内肿瘤 宫颈鳞状上皮内肿瘤(CIN)3级 8077/2 原位鳞状细胞癌 8070/2 良性鳞状上皮病变 尖锐湿疣 鳞状上皮乳头状瘤 8052/0 纤维上皮性息肉 腺上皮肿瘤及其癌前病变 腺癌 8140/3 粘液腺癌 8480/3 宫颈型 8482/3 肠型 8144/3 印戒细胞型 8490/3 微小偏离型 8480/3 绒毛腺型 8262/3 子宫内膜样腺癌 8380/3 透明细胞腺癌 8310/3 浆液性腺癌 8441/3 中肾管型腺癌 9110/3 早期浸润性腺癌 8140/3 原位腺癌 8140/2 腺体不典型增生 良性腺上皮病变 苗勒氏管源性乳头状瘤 宫颈管内膜息肉 其他上皮性肿瘤 腺鳞癌 8560/3 毛玻璃细胞亚型 8015/3 腺样囊性癌 8200/3 |
|
| 腺样基底细胞癌 8098/3 神经内分泌肿瘤 类癌 8240/3 非典型类癌 8249/3 小细胞癌 8041/3 大细胞神经内分泌癌 8013/3 未分化癌 8020/3 间叶性肿瘤和肿瘤样病变 平滑肌肉瘤 8890/3 子宫内膜样间质肉瘤,低度恶性 8931/3 未分化宫颈管肉瘤 8805/3 葡萄状肉瘤 8910/3 腺泡状软组织肉瘤 9581/3 血管肉瘤 9120/3 恶性外周神经鞘肿瘤 9540/3 平滑肌瘤 8890/0 生殖道型横纹肌瘤 8905/0 手术后梭形细胞结节
上皮和间叶混合性肿瘤 癌肉瘤(恶性苗勒氏管源性混合瘤;化生性癌) 8980/3 腺肉瘤 8933/3 Wilms肿瘤 8960/3 腺纤维瘤 9013/0 腺肌瘤 8932/0 黑色素细胞肿瘤 恶性黑色素瘤 8720/3 蓝痣 8780/0
杂类肿瘤 生殖细胞型肿瘤 卵黄囊瘤 9071/3 表皮样囊肿 9084/0 成熟性囊性畸胎瘤 9080/0
淋巴造血组织肿瘤 恶性淋巴瘤(特殊类型) 白血病(特殊类型) 继发性肿瘤 | |
5.2 CIN的分级及子宫颈癌的分期
CIN分级
CIN1(轻度非典型增生) 细胞异型性轻,排列不整齐,但仍保持极性,异常增殖细胞限于上皮层下1/3。
CIN2(中度非典型增生) 细胞异型性明显,排列较紊乱,异常增殖细胞占据上皮层下2/3。
CIN3(重度非典型增生及原位癌) 重度非典型增生的上皮细胞异型性显著,失去极性,异常增殖细胞扩展至上皮的2/3或几乎全层,难以与原位癌区别。原位癌的上皮异型性细胞累及全层,极性消失,核异型性显著,核分裂相多见。上皮基底膜完整,无间质浸润。
宫颈癌分期
目前采用的是国际妇产科联盟(FIGO)2009年会议修改的子宫颈癌临床分期标准,由妇科检查确定临床分期。
子宫颈癌的国际妇产科联盟(FIGO 2009)分期
I 肿瘤严格局限于宫颈(扩展至宫体将被忽略)
Ia 镜下浸润癌。间质浸润≤5 mm,水平扩散≤7 mm
Ia1 间质浸润≤3 mm,水平扩散≤7 mm
Ia2 间质浸润>3 mm,但≤5 mm,水平扩展≤7 mm
Ib 肉眼可见病灶局限于宫颈,或临床前病灶>Ia期
Ib1 肉眼可见病灶最大径线≤4 cm
Ib2 肉眼可见病灶最大径线> 4 cm
II 肿瘤超过子宫颈,但未达骨盆壁或未达阴道下1/3
IIa 无宫旁浸润
IIa1 肉眼可见病灶最大径线≤4 cm
IIa2 肉眼可见病灶最大径线> 4 cm
IIb 有明显宫旁浸润,但未扩展至盆壁
III 肿瘤扩展到骨盆壁和(或)累及阴道下1/3和(或)引起肾盂积水或肾无功能者
IIIa 肿瘤累及阴道下1/3,没有扩展到骨盆壁
IIIb 肿瘤扩展到骨盆壁和(或)引起肾盂积水或肾无功能
IV 肿瘤侵犯邻近器官(膀胱及直肠)或肿瘤播散超出真骨盆。
Iva 肿瘤侵犯膀胱或直肠粘膜(活检证实)。泡状水肿不能分为IV期。
IVb肿瘤播散至远处器官。
6 诊断和确诊
子宫颈癌的正确诊断,源于详细了解病史,熟悉临床表现以及必要而细致地检查和周密地分析。组织学活检病理是最终确诊的金标准。
7 鉴别诊断
7.1 宫颈良性病变,如宫颈重度糜烂、宫颈结核、生长活跃的息肉、宫颈粘膜下肌瘤、宫颈腺上皮外翻和其他宫颈炎性溃疡等。
7.2 转移性子宫颈癌,较多见的是原发子宫内膜癌转移至宫颈。
宫颈活检可排除上述病变。
8 治疗
8.1 癌前病变(子宫颈上皮内瘤变,CIN)的治疗:
8.1.1 CIN I的处理
(a)观察:阴道镜检查满意者可观察;阴道镜检查不满意者应作颈管内膜刮术(ECC),排除颈管内病变。
(b)随访:6个月后复查细胞学,如无异常一年以后复查细胞学。如细胞学结果>ASCUS需要阴道镜检查。
8.1.2 CIN II、III的处理:
(a)观察:只限于妊娠期的CINII、III的观察,应该每2个月进行一次阴道镜检查,产后6-8周再次进行评估处理。
(b)治疗:可选择宫颈环形电切术(LEEP)或冷刀宫颈锥形切除,根据锥切病理选择进一步治疗方法,单纯子宫切除术不可作为首选治疗。(注:根据术后病理结果可判断手术范围是否足够,并决定下一步治疗方法,因此锥切病理的诊断水平非常重要,建议医疗条件不够的医疗单位可将标本固定后转到上级医院进行病理诊断。)
(c)随访:每3-6个月的细胞学连续3次正常后,可选择每年1次的细胞学,必要时阴道镜随访。HPV检测也有助于CIN的随访,各医疗单位可结合自身及患者的具体情况酌情应用。
8.2 子宫颈癌的治疗方式
子宫颈癌的治疗手段包括手术、放疗、化疗和多种方式联合的综合治疗。总体治疗原则早期子宫颈癌患者(I-IIA)单纯根治性手术与单纯根治性放疗两者治疗效果相当,5年生存率、死亡率、并发症几率相似。各期子宫颈癌均可选择放射治疗,对于IIB以上中晚期子宫颈癌采用应以顺铂为基础的同步放化疗,治疗方式应根据病人年龄、病理类型,分期综合考虑予以选择。
8.2.1手术治疗
子宫颈癌手术治疗主要应用于早期宫颈癌即 Ia-IIa期。对于局部晚期、大癌灶Ib2-IIa(>4cm)患者治疗选择仍存在不同的意见。2006年国际妇产科联盟(FIGO)公布的子子宫颈癌治疗指南认为,可供选择的方式有如下几种(a) 同步放化疗,(b) 广泛子宫切除和盆腔淋巴清扫、腹主动脉淋巴结取样、术后个体化辅助治疗,(c)新辅助化疗后广泛子宫切除术和盆腔淋巴结切除及腹主动脉淋巴结取样术、术后个体化治疗。由于放疗可能导致的阴道狭窄会使患者更倾向于选择根治性手术,特别是中、青年患者。大量研究已经证明,根治性手术加放疗的并发症较多,应尽量避免根治术后又行盆腔放疗, 因此首选根治性手术还是放疗时,应根据病情,慎重考虑。
对选择手术治疗的患者附件的处理。对要求保留卵巢功能的未绝经患者,一般认为早期宫颈鳞癌卵巢转移的几率较低可以保留卵巢,但术中需探查卵巢情况。有人认为腺癌发生隐匿性卵巢转移的几率较高,故不应保留卵巢,但资料有限无法客观评价这一看法。对保留的卵巢,手术时应常规将所保留的卵巢移位(如腹腔内结肠旁沟),以避免术后盆腔放疗对卵巢功能的损伤。
手术类型:
I型扩大子宫切除即筋膜外子宫切除术。
II型扩大子宫切除即次广泛子宫切除术:切除1/2骶、主韧带和部分阴道。
III型扩大子宫切除即广泛子宫切除术:靠盆壁切除骶、主韧带和上1/3阴道。
IV型扩大子宫切除即超广泛子宫切除术。
V型扩大子宫切除即盆腔脏器廓清术。
近年来对一些渴望生育的早期子宫颈癌年轻患者施行根治性宫颈切除术以保留子宫和生育功能,但是其适应证和疗效仍有待进一步研究。
8.2.2 放射治疗
(对于没有放射治疗条件的医疗机构应及时转诊到上级有条件的医疗单位进行治疗)
适用于各期子宫颈癌,但主要应用于ⅡB期以上中晚期患者及早期但不能耐受手术治疗者。放疗包括体外照射和腔内治疗,二者联合应用。研究表明同步放化疗较单纯放疗提高了疗效,降低了复发风险。手术患者如存在手术切缘不净、有淋巴转移等高危因素,术后需辅助放疗。
(a)放射治疗原则
恶性肿瘤的放射治疗原则与其他治疗手段一样,要最大限度地杀灭癌细胞,尽最大可能保护正常组织和重要器官,即尽量提高治疗效果,降低并发症。因此,适当的治疗工具、适宜的照射范围、足够的照射剂量、均匀的剂量分布、合理的照射体积、个别对待是放射治疗的基本要求。
行根治性放射治疗时,对肿瘤区域给予根治剂量照射,由于照射范围较大,照射剂量也高。因此,对肿瘤附近的正常组织和器官,特别是一些对放射线敏感的组织和器官的防护,就成为治疗中的一个重要问题。如果放射治疗方案设计不当就容易引起严重的后遗症。姑息性放射治疗的目的是为了减轻症状,减少病人痛苦,但不一定延长病人的生存时间。根治性治疗与姑息性治疗是相对的,在治疗过程中可根据肿瘤及病人情况而互相转换。
若放射治疗作为与手术配合的综合治疗时,要根据肿瘤情况及病人条件决定是术前放射治疗还是术后放射治疗。术前放射治疗是计划性的,其目的是通过术前放射治疗,降低癌细胞活力或减少种植和扩散的机率;缩小肿瘤范围,提高手术切除率;杀伤亚临床病灶,降低局部复发率。术后放射治疗是根据手术后病理决定,具有不良预后影响因素:如淋巴结转移、切缘阳性、宫旁浸润、深肌层浸润、宫颈局部肿瘤体积大以及脉管瘤栓等,可行术后放射治疗,减少局部复发,提高疗效,但两种治疗并用也增加了治疗并发症。
(b)近距离照射
将密封的放射源直接放入人体的天然管腔内(如子宫腔、阴道等)为腔内照射。放射源直接放入肿瘤组织间进行照射为组织间照射,二者统称为近距离照射。子宫颈癌的腔内放疗有其自然的有利条件,宫颈、宫体及阴道对放射线耐受量高、放射源距肿瘤最近、以较小的照射体积可取得较大的放疗效果。
(1)体内照射的放射源:
| 放射源 | 镭226 | 钴60 | 铯137 | 铱192 |
| 放射比度(Ci/cm3) | 2.1 最高3.8 | 1900 | 27.5 | 9000
|
| 半衰期(年) | l590 | 5.3 | 33 | 0.2(74天) |
(2)传统的腔内照射法:斯德哥尔摩法、巴黎法、曼彻斯特法和北京法等,多使用的是镭、铯放射源,目前已较少使用。
(3)后装腔内放射治疗:
后装腔内放射治疗是先将空载的放射容器置于体腔内病变部位,然后在有防护屏蔽的条件下远距离地将放射源通过管道传输到容器内进行治疗。后装腔内治疗机根据其对“A”点放射剂量率的高低可分为三类:低剂量率(0.667~3.33cGY/min)、中剂量率(3.33~20cGY/min)、高剂量率(在20cGY/min以上)。
后装腔内放疗的治疗计划系统多模拟经典的斯德哥尔摩法、巴黎法等。后装腔内治疗的方法很多,一般情况下每周1-2次,每周“A”点剂量在5-10GY,“A”点总剂量在35-45GY,整个疗程体外加腔内放疗剂量因临床分期、肿瘤大小的不同而异,一般总剂量在75GY-90GY。
(4)腔内放疗剂量的计算: 后装腔内放疗剂量是以“A”点为参考点计算的。由于每次治疗时放射源的位置不可能完全相同,肿瘤体积亦经常在变化。理论上的“A”点剂量与实际剂量相差甚远,肿瘤是立体的。只用一点的剂量来表示也同样不能反映出肿瘤的真正受量,三维后装腔内治疗机的计划系统可以设计出较理想的、立体的放射治疗剂量曲线,这比“A”点参考剂量更有意义。
(c)体外照射
(1)体外照射剂量参考点 多年来一般均以“B”点为子宫颈癌体外照射量的计算点。F1etcher于1980年提出了淋巴区梯形定位法:从耻骨联合上缘中点至骶骨1~2之间连线,在此线中点与第4腰椎前连成一线,在此线中点平行向两侧延伸6cm,此点为髂外淋巴区域。在第4腰椎中点平行向两侧延伸2cm,此点为腹主动脉旁淋巴区域。髂外区与腹主动脉旁区联线的中点为髂总淋巴区。Chassagne等提出:以髋臼上缘最高点作一平行线与髋臼外缘的垂直线交叉为盆壁参考点,代表宫旁组织盆壁端及闭孔淋巴结的区域。
(2)常规放疗:(在模拟机或CT模拟机下定位)
靶区:一般应当包括子宫、宫颈、宫旁和上1/2阴道,盆腔淋巴引流区如髂内、闭孔、髂外、髂总淋巴结。IIIa期病人包括全部阴道。必要时包括腹股沟区。
采用四野箱式照射或等中心前后对穿照射。应用高能6--12MVX射线。
界限:上界:L5上缘水平;下界:闭孔下缘(IIIa期病人除外), 其端点与设野最宽处的连线约通过股骨内三分之一;外界:在真骨盆外1.5-2.0cm;前界:耻骨联合前缘(据不同肿瘤而定);后界:全部骶骨在照射野内(据不同肿瘤而定)。
应用多叶光栅或不规则挡铅屏蔽保护正常组织。
剂量:采用常规分割照射,1.8~2.0Gy/次,5次/周。Ⅰ~Ⅱ期:45Gy/1.8-2Gy/4.5-5周,Ⅲ~Ⅳ期:45-50Gy/1.8-2Gy/5-6周。
(3)三维适形放疗及调强适形放疗:
根据妇科检查以及影像学情况确定肿瘤靶区(GTV),以宫颈癌直接扩散和淋巴结转移途径确定临床靶区(CTV),一般包括子宫(未行手术者)、宫颈、上1/2阴道(阴道浸润达下1/3,进行全阴道照射)、宫旁、闭孔、髂内、髂外、髂总淋巴结。以CTV外放一定距离(0.5-1.0cm)形成PTV。放疗剂量:50Gy/1.8-2Gy/5-6周,靶区内剂量均匀性在±5%范围内,同时评估危及器官,如直肠,乙状结肠,膀胱,小肠,髂骨,骶尾骨,耻骨,股骨头,股骨颈等。
(d)腔内照射与体外照射的组合
除极少数早期子宫颈癌只行腔内照射外,均需腔内及体外联合照射,在子宫颈癌的靶区内组成剂量分布较均匀的有效治疗。
(e)放射治疗并发症
由于放射源种类、放射方法、照射面积、照射部位、单位剂量、总剂量、总的分割次数及总治疗时间等因素的不同,以及病人对放射线敏感性的差异,放射治疗并发症的发生机率及严重程度也各不相同。放射治疗工作者一方面要了解放射治疗并发症,另一方面要熟悉腹、盆腔器官对放射线的耐受剂量,以减少放射治疗的并发症。
(1)早期并发症:包括治疗中及治疗后不久发生的并发症,如感染、阴道炎、外阴炎、皮肤干湿性反应、骨髓抑制、胃肠反应、直肠反应、膀胱反应和机械损伤等。
(2)晚期并发症:常见的有:放射性直肠炎、放射性膀胱炎、皮肤及皮下组织的改变、生殖器官的改变、放射性小肠炎等。最常见的是放射性直肠炎,多发生在放疗后1-1.5年,主要表现为:大便次数增多、粘液便、便血,严重者可出现直肠阴道瘘,其次常见的是放射性膀胱炎,多数在1年半左右,主要表现为尿频、尿痛、尿血、排尿不畅,严重者可出现膀胱阴道瘘。
8.2.3 化学治疗
化疗在子宫颈癌治疗中的作用越来引起重视,主要应于用放疗病人的化疗增敏(同步放化疗)、新辅助化疗以及晚期远处转移、复发患者的姑息治疗等。治疗子宫颈癌的有效药有顺铂、紫杉醇、5-氟尿嘧啶、异环磷酰胺、吉西他滨、拓扑替康等。
(a)增敏化疗
目前NCCN治疗指南推荐的在放疗期间增敏化疗的方案是:
DDP:50-70mg/m2 + 5FU:4g/m2(96小时持续静脉滴入),放疗第1和29天。
DDP周疗:40mg/m2,放疗第1、8、15、22、29和36天。
(b)新辅助化疗
新辅助化疗(neoadjuvant chemotherapy,NAC)是指患者在手术前行2~3个疗程的化疗,目的在于:缩小肿瘤体积,消灭微转移灶和亚临床病灶,使原来不能手术的患者获得手术机会。一些非随机研究表明,根据术后病理诊断情况,新辅助化疗减少了术中播散及术后转移的几率。目前主要用于局部肿瘤大的早期患者。NAC化疗方案常为以铂类为基础的联合方案。如PVB方案(顺铂+长春新碱+博来霉素),PF方案(顺铂+5-Fu),BIP方案(顺铂+博莱霉素+异环磷酰胺+美司钠)等。给药途径: 静脉全身化疗或动脉插管介入化疗,几种疗效相近。新辅助化疗的最佳方案及给药途径尚未达成统一意见。FIGO(2006)推荐NAC化疗方案:顺铂 50 mg/m2 IV,d1+VCR 1mg/m2 IV,d1+BLM15mg,IV,d1-3每10天重复,共3次。
(c)姑息化疗
复发或转移的宫颈癌化疗主要用于既不能手术也不能放疗的患者。2009年NCCN子宫颈癌治疗指南推荐的用于复发或转移癌的一线化疗方案有:卡铂/紫杉醇、顺铂/紫杉醇、顺铂/拓朴替康和顺铂/吉西他滨。可供选择的一线单药化疗药物有:卡铂、顺铂、紫杉醇、吉西他滨和拓扑替康。二线化疗药物有:多西紫杉醇、表阿霉素、5-氟尿嘧啶、异环磷腺胺、伊立替康、丝裂霉素等。
8.3 子宫颈癌分期治疗模式
8.3.1宫颈早期间质浸润癌
宫颈早期间质浸润癌即IA期,由于IA期肿瘤的判定依据显微镜下测量,活检标本不能包含全部病变,无法进行病变范围的测量,故正确诊断需行锥切活检。所以准确地诊断IA期子宫颈癌需对切缘阴性的锥切标本进行细致的病理检查。
IA1期病变,没有生育要求者可行筋膜外全子宫切除术(I型扩大子宫切除手术)。如果病人有生育要求,可行宫颈锥切,切缘阴性可定期随访。因IA1期淋巴结转移的几率 <1%,大多数学者认为IA1期患者无需行淋巴结切除术。如淋巴脉管受侵则行改良根治性子宫切除和盆腔淋巴结切除术。
IA2期子宫颈癌有潜在的淋巴结转移率,约为3%-5%,可行次广泛子宫切除术(II型扩大子宫切除术)加盆腔淋巴结切除术。要求保留生育功能者,可选择广泛宫颈切除加盆腔淋巴结切除术(对于有生育要求的患者建议转上级医疗单位实施广泛宫颈切除术)。
8.3.2宫颈浸润癌
(a)IB1, IIA(<4cm)期
采用手术或放疗, 预后均良好。标准手术治疗方法是广泛子宫切除术(III型扩大子宫切除术)和盆腔淋巴结切除术。术后有复发高危因素(宫旁受侵、深肌层浸润和淋巴结转移)应该采用同步放化疗(5FU+顺铂或单用顺铂),可以减少盆腔复发、改善生存率。要求保留生育功能者,且宫颈肿瘤直径不超过2cm,可选择广泛宫颈切除加盆腔淋巴结切除术。
(b)IB2、IIA(>4cm)期
可选择的治疗方法有如下几种:(1)同步放化疗;(2)广泛子宫切除和盆腔淋巴清扫、腹主动脉淋巴结取样、术后个体化辅助治疗;(3)新辅助化疗后广泛子宫切除术和盆腔淋巴结切除及腹主动脉淋巴结取样术、术后个体化治疗。
IB期的总生存率约80-90%,而宫颈直径大于4cm,有淋巴结转移、宫旁受侵和/或切缘阳性等高危因素者总生存率仅40-70%。对早期初治子宫颈癌患者选择治疗方法时,应考虑到有高危因素的患者可能选择放化疗更为有利。大量研究已经证明,根治性手术加放疗的并发症较多,应尽量避免根治术后又行盆腔放疗。
(c)IIB及IIB期以上
同步放化疗(具体方案详上述放射治疗及增敏化疗)
9 随访
对于新发子宫颈癌患者应建立完整病案和相关资料档案,治疗后定期随访监测。具体内容如下:
宫颈或阴道细胞学检查在治疗后头2年每3-6个月1次,第3-5年每6个月1次,然后每年随诊1次。胸片每年1次。有临床指征时做CT扫描。
建议放疗后使用阴道扩张器。尽早恢复性生活有利于减少阴道粘连狭窄。
附录A
CIN分级及宫颈浸润癌分期
CIN分级
CIN1(轻度非典型增生) 细胞异型性轻,排列不整齐,但仍保持极性,异常增殖细胞限于上皮层下1/3。
CIN2(中度非典型增生) 细胞异型性明显,排列较紊乱,异常增殖细胞占据上皮层下2/3。
CIN3(重度非典型增生及原位癌) 重度非典型增生的上皮细胞异型性显著,失去极性,异常增殖细胞扩展至上皮的2/3或几乎全层,难以与原位癌区别。原位癌的上皮异型性细胞累及全层,极性消失,核异型性显著,核分裂相多见。上皮基底膜完整,无间质浸润。
子宫颈癌的国际妇产科联盟(FIGO 2009)分期
I 肿瘤严格局限于宫颈(扩展至宫体将被忽略)
Ia 镜下浸润癌。间质浸润≤5 mm,水平扩散≤7 mm
Ia1 间质浸润≤3 mm,水平扩散≤7 mm
Ia2 间质浸润>3 mm,且≤5 mm,水平扩展≤7 mm
Ib 肉眼可见病灶局限于宫颈,或临床前病灶>Ia期
Ib1 肉眼可见病灶最大径线≤4 cm
Ib2 肉眼可见病灶最大径线> 4 cm
II 肿瘤超过子宫颈,但未达骨盆壁或未达阴道下1/3
IIa 无宫旁浸润
IIa1 肉眼可见病灶最大径线≤4 cm
IIa2 肉眼可见病灶最大径线> 4 cm
IIb 有明显宫旁浸润
III 肿瘤扩展到骨盆壁和(或)累及阴道下1/3和(或)引起肾盂积水或肾无功能者
IIIa 肿瘤累及阴道下1/3,没有扩展到骨盆壁
IIIb 肿瘤扩展到骨盆壁和(或)引起肾盂积水或肾无功能
IV 肿瘤播散超出真骨盆或(活检证实)侵犯膀胱或直肠粘膜。泡状水肿不能分为IV期
Iva 肿瘤播散至邻近器官(肿瘤侵及膀胱及直肠粘膜)
IVb肿瘤播散至远处器官
附录B
病人状况评分
B.1 Karnofsky评分(KPS,百分法)评分见表C.1。
表C.1 Karnofsky评分
| 100 90 80 70 60 50 40 30 20 10 0 | 正常,无症状和体征,无疾病证据 能正常活动,有轻微症状和体征 勉强可进行正常活动,有一些症状或体征 生活可自理,但不能维持正常生活或工作 生活能大部分自理,但偶尔需要别人帮助,不能从事正常工作 需要一定帮助和护理,以及给与药物治疗 生活不能自理,需要特别照顾和治疗 生活严重不能自理,有住院指征,尚不到病重 病重,完全失去自理能力,需要住院和积极的支持治疗 重危,临近死亡 死亡 |
附录C
放射及化学治疗疗效判定标准
C.1 WHO实体瘤疗效评价标准(1981):
00001—— 完全缓解(CR),肿瘤完全消失超过1个月。
00002—— 部分缓解(PR),肿瘤最大直径及最大垂直直径的乘积缩小达50%,其他病变无增大,持续超过1个月。
00003—— 病变稳定(SD),病变两径乘积缩小不超过50%,增大不超过25%,持续超过1个月。
00004—— 病变进展(PD),病变两径乘积增大超过25%。
C.2 RECIST疗效评价标准(2000):
C.2.1 靶病灶的评价
00005—— 完全缓解(CR),所有靶病灶消失。
00006—— 部分缓解(PR),靶病灶最长径之和与基线状态比较,至少减少30%。
00007—— 病变进展(PD),靶病灶最长径之和与治疗开始之后所记录到的最小的靶病灶最长径之和比较,增加20%,或者出现一个或多个新病灶。
00008—— 病变稳定(SD),介于部分缓解和疾病进展之间。
C.2.2 非靶病灶的评价
00009—— 完全缓解(CR),所有非靶病灶消失和肿瘤标志物恢复正常。
00010—— 未完全缓解/稳定(IR/SD),存在一个或多个非靶病灶和/或肿瘤标志物持续高于正常值。
00011—— 病变进展(PD),出现一个或多个新病灶和/或已有的非靶病灶明确进展。
C.2.3 最佳总疗效的评价
最佳总疗效的评价是指从治疗开始到疾病进展或复发之间所测量到的最小值。通常,病人最好疗效的分类由病灶测量和确认组成。
附录D
子宫颈癌的基本情况
子宫颈癌是常见的妇科恶性肿瘤之一, 发病率在我国女性恶性肿瘤中居第二位, 位于乳腺癌之后。据世界范围内统计, 每年约有50万左右的子宫颈癌新发病例, 占所有癌症新发病例的5%, 其中的80%以上的病例发生在发展中国家。我国每年约有新发病例13万, 占世界子宫颈癌新发病例总数的28%。
患病的高峰年龄为40~60岁左右,近年来大量研究表明,子宫颈癌的发病年龄呈年轻化趋势。子宫颈癌发病率分布有地区差异,农村高于城市,山区高于平原,发展中国家高于发达国家。因此,十分有必要在全国范围内规范子宫颈癌的诊断与治疗。另一方面,子宫颈癌的发生可通过对癌前病变的检查和处理得以有效控制。西方国家的经验显示,子宫颈癌的发生率在密切筛查的人群中减少了70%~90%。为了降低我国子宫颈癌的发病率,做到子宫颈癌的早诊早治,本指南补充了子宫颈癌前病变的诊治原则,希望能降低宫颈病变对广大妇女的危害,同时减少国家对子宫颈癌的诊治支出。
参考文献
1. Jemal A, Siegel R, Ward E, et al. Cancer Statistics, 2007. CA Cancer J Clin 2007;57: 43-66.
2. Howe HL, Wu X, Ries LA, et al. Annual report to the nation on the status of cancer, 1975-2003, featuring cancer among U.S. Hispanic/Latino populations. Cancer 2006;107(8):1711-1742.
3. Sherman ME, Wang SS, Carreon J, Devesa SS. Mortality trends for cervical squamous and adenocarcinoma in the United States. Relation to incidence and survival. Cancer 2005;103(6):1258-1264. 4. Parkin DM, Bray F, Ferlay J. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108.
5. Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol 2006;24(14):2137-2150.
6. Villa LL, Costa RL, Petta CA, et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomized double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol 2005;6:271-278.
7. Ault KA; Future II Study Group. Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet 2007;369(9576):1861-1868.
8. FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007;356(19):1915-1927.
9. Arbyn M, Dillner J. Review of current knowledge on HPV vaccination: an appendix to the European Guidelines for Quality Assurance in Cervical Cancer Screening. J Clin Virol 2007;38(3):189-197. Epub 2007 Jan 25.
10. American College of Obstetricians and Gynecologists.ACOG practice bulletin. Diagnosis and treatment of cervical carcinomas. Number 35, May 2002. Int J Gynaecol Obstet 2002;78:79-91.
11. Chi DS. Laparoscopy in gynecologic malignancies. Oncology 1999;13:773-782.
12. Benedet JL, Bender H, Jones H 3rd, et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO Committee on Gynecologic Oncology. Int J Gynaecol Obstet 2000;70:209-262.
13. Landoni F, Maneo A, Colombo A, et al. Randomized study of radical surgery vs. radiotherapy for stage Ib-IIa cervical cancer. Lancet 1997;350:535-540.
14. Rose PG, Ali S, Watkins E, et al. Long-term follow-up of a randomized trial comparing concurrent single agent cisplatin, cisplatin-based combination chemotherapy, or hydroxyurea during pelvic irradiation for locally advanced cervical cancer: a Gynecologic Oncology Group Study. J Clin Oncol 2007;25(19):2804-2810. Epub 2007 May 14.
15. Monk BJ, Tewari KS, Koh W-J. Multimodality therapy for locally advanced cervical carcinoma: state of the art and future directions. J Clin Oncol 2007;25:2952-2965.
16. Pearcey R, Miao Q, Kong W, et al. Impact of adoption of chemoradiotherapy on the outcome of cervical cancer in Ontario: results of a population-based cohort study. J Clin Oncol 2007;25(17):2383-2388.
17. Haie-Meder C, Fervers B, Fondrinier E, et al. SOR guidelines for concomitant chemoradiotherapy for patients with uterine cervical cancers: evidence update bulletin 2004. Ann Oncol 2005;16:1100-1108.
18. Koliopoulos G, Sotiriadis A, Kyrgiou M, et al. Conservative surgical methods for FIGO stage IA2 squamous cervical carcinoma and their role in preserving women's fertility. Gynecol Oncol 2004;93:469-473.
19. Bernardini M, Barrett J, Seaward G, et al. Pregnancy outcomes in patients after radical trachelectomy. Am J Obstet Gynecol 2003;189:1378-1382.
20. Boss EA, van Golde RJ, Beerendonk CC, et al. Pregnancy after radical trachelectomy: A real option? Gynecol Oncol 2005;99:S152-6. Epub 2005 Sep 2.
21. Plante M, Renaud MC, Hoskins IA, Roy M. Vaginal radical trachelectomy: a valuable fertility-preserving option in the management of early-stage cervical cancer. A series of 50 pregnancies and review of the literature. Gynecol Oncol 2005;98(1):3-10.
22. Marchiole P, Benchaib M, Buenerd A, et al. Oncological safety of laparoscopic-assisted vaginal radi cal trachelectomy (LARVT or (LARVH). Gynecol Oncol
Dargent's operation): A comparative study with laparoscopic-assisted vaginal radical hysterectomy2007;106(1):132-141. Epub 2007 May 9.
23. Shepherd JH, Spencer C, Herod J, Ind TE. Radical vaginal trachelectomy as a fertility-sparing procedure in women with early-stage cervical cancer-cumulative pregnancy rate in a series of 123 women. BJOG 2006;113(6):719-724.
24. Landoni F, Zanagnolo V, Lovato-Diaz L, et al. Ovarian metastases in early-stage cervical cancer (IA2-IIA): a multicenter retrospective study of 1965 patients (a Cooperative Task Force study). Int J Gynecol Cancer 2007;17(3):623-628. Epub 2007 Feb 16.
25. Shimada M, Kigawa J, Nishimura R, et al. Ovarian metastasis in carcinoma of the uterine cervix. Gynecol Oncol 2006;101(2):234-237. Epub 2005 Nov 21.
26. Keys HM, Bundy BN, Stehman FB, et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med 1999;340:1154-1161.
27. Morris M, Eifel PJ, Lu J, et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med 1999;340:1137-1143.